水と電気の関係。純水は電気を通さない?(電気の基礎知識)

電気の話なのに、
なぜ水が出てくるのか?
これには理由があります。
実は、
次にお話しする「イオン」を理解する為には、
「水」というものについての理解を深める必要があるからです。
学生時代の復習と思って
「水」を振り返ってみましょう。
水の構成
水とは、
みなさんもご存知の通り
H2Oですね。
まずはこれを分解していきましょう。
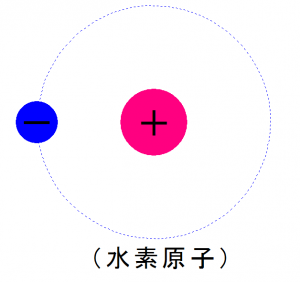
水素原子は
陽子1個、電子1個で構成されています。
しかし、
電子殻の一番内側のK殻は、
電子が二つ入るスペースがあります。
このK殻にひとつ空きがある為、
このままでは不安定な状態です。
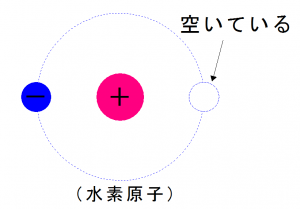
そこに、
もうひとつ水素原子が現れたらどうでしょうか?
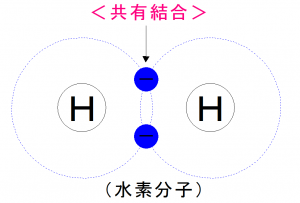
電子を共有することによってK殻が埋まり、
安定することが出来ました。
この電子殻を共有することにより結合することを
<共有結合>といいます。
このように、
通常、
水素は単体では分子として存在します。
続いて酸素です。
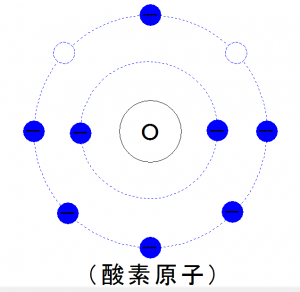
酸素は、
電子殻の最外殻に二つの空きがあります。
水素同様、
そのままでは安定しないので、
原子が二つくっついて酸素分子O2、
三つでオゾンO3など。
その他、
二酸化炭素など様々な元素とくっつくことにより安定します。
この酸素原子の隙間に、
水素原子がくっついたらどうなるでしょう。
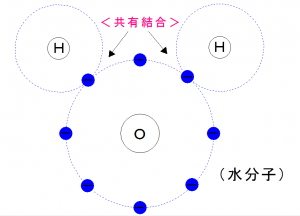
互いの電子を共有することにより安定し、
H2O=「水」分子になりました。
しかし、
ここで一つ気になることが。
電気とは?(電気の基礎知識)
で、
陽子は(+)、
電子は(-)の電荷を持っているという
お話をしました。
この水分子を見てみると、
水素は酸素に電子を奪われている。
酸素は水素から電子をもらっている。
のようになりますよね。
ということは、
電子が酸素側に偏ってしまっているので、
水素は電子の影響がなくなり(+)に帯電。
酸素は電子を2つもらうことにより(-)に帯電。
水分子は、
分子そのものに極性を持つ。
ということになります。
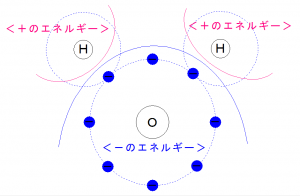
これを<極性分子>といいます。
続いて、
水分子が2つある状況をイメージしてみます。
水分子に(+)と(-)の極性があるということは、
異なる極性同士は引きつけ合うということが起こります。
水素の部分は酸素の部分に、
酸素の部分は水素の部分に。
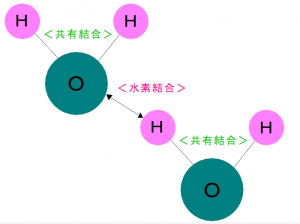
引き付け合うことによって、
水素が水分子同士を結合しているように見えます。
このように、
水素を介して結合することを<水素結合>といいます。
結合と呼ぶにはその力はあまり強くない為、
分子間力とも呼ばれます。
水分子がたくさんあるとこのようになります。
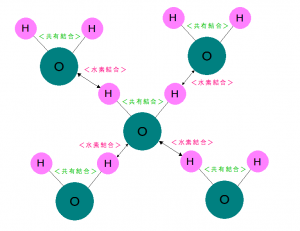
このいくつかの水分子の固まりのことを
<クラスター>といいます。
水素結合の力は弱いため、
水の中では水分子同士がくっついたり離れたりを繰り返し、
このクラスターの大きさが絶えず変化しています。
余談ですが、
氷が水に浮く理由は、
このクラスターが関係しています。
水が液体の時には
水分子が動き回っているのでクラスターが変化し、
互いの隙間を埋めるので、密度が高いです。
一方、
水が冷やされていくと、
水分子の動きが止まっていき、
クラスターに隙間を作ったまま凍ります。
隙間がたくさんあるので密度は低くなり体積は大きくなります。
その為、
密度の低い氷は密度の高い水に浮き、
体積も大きくなるのです。
「水は電気をよく通す」
みなさんもご存知の通り、
水は電気をよく通します。
しかし、
純粋な水は電気を通しません。
なぜでしょうか?
電気は、
自由電子の移動でしたよね?
純粋な水は、
水素と酸素の共有結合が強く
電子が結合の束縛から離れることが出来ません。
電子が動くことが出来ないので、
電気を通すことがないのです。
ではなぜ水は電気を通すと言われているのか?
そのポイントが
次回お話しします「イオン」が関わってくるのです。
今回のポイントは、
※水分子には極性がある
このことを覚えておいてください。
次回は「イオン」についてです。
イオンとは?日常でよく耳にするイオンの正体(電気の基礎知識)








